Заморозить на бегу. Нобелевка по химии сможет помочь победить рак

В среду, 4 октября, Шведская королевская академия наук объявила лауреатов Нобелевской премии по химии за 2017 г. Премию получили Жак Дюбоше, Йоахим Франк и Ричард Хендерсон с формулировкой "за развитие криоэлектронной микроскопии высокого разрешения для определения структуры биомолекул в растворе".
Жак Дюбоше - швейцарский биофизик из Университета Лозанны, Йоахим Франк - профессор Университета Колумбии (США), Ричард Хендерсон работает в лаборатории молекулярной биологии Кембриджа (Великобритания). Примечательно, что сотрудники последней десять раз становились нобелевскими лауреатами, а в целом Университет Кембриджа может похвастаться 97 нобелевскими лауреатами - абсолютный рекорд среди вузов мира.
Сразу после оглашения победителей Йоахим Франк подчеркнул, что метод криоэлектронной микроскопии - прорыв в молекулярной медицине. Ведь сегодня ученые могут наблюдать не только за работой целых органов и клеток, но и изучать строение и функционирование отдельных молекул.
Нобелевский комитет в своем решении отметил, что многие ключевые научные открытия удалось осуществить именно благодаря развитию техники - ученые часто не могли подтвердить свои предположения просто потому, что не существовало необходимых приборов. В частности, от таких белых пятен страдали биохимики. Криоэлектронная микроскопия все изменила: сегодня ученые могут визуализировать процессы, ключевые как для понимания химии жизни, так и для создания лекарств.
Сама техника состоит в наблюдении за веществами, например, белками, в их природной среде в трех измерениях. "Это позволяет точно оценить структуру каждой молекулы (на уровне атома), а также отслеживать, как движутся элементы белка, как они соединяются друг с другом, создают комплексы и взаимодействуют", - отметила председатель Нобелевского комитета по химии Сара Сногеруп Линсе. Причем наблюдать можно за любым атомом, который находится в клетке живого организма, не повреждая при этом саму клетку. Так, при помощи этого метода удалось подробно изучить строение вируса Зика, что стало ключевым для разработки лечения.
Именно благодаря новым Нобелевским лауреатам современные ученые могут заглянуть внутрь молекулы.
Заморозить клетку
Биохимики долгие годы мечтали о том, чтобы наблюдать за молекулами в их среде без окрашивания или какой-либо фиксации химическими веществами. В частности, образцы пробовали замораживать, но появляющиеся в процессе заморозки кристаллы искажали молекулы.
Около 30 лет назад Ричард Хендерсон начал изучать белки при помощи классической рентгеновской кристаллографии. Однако вскоре понял, что этот метод имеет значительные ограничения. Тогда Хендерсон решил использовать электронный микроскоп, хотя эту технику обычно применяли для изучения уже мертвых тканей - биологические образцы разрушались под действием электронов. В 1990-м Хендерсону благодаря электронному микроскопу удалось создать модель белка - бактериородопсина - в высоком разрешении. Это доказывало, что электронный микроскоп можно использовать и в биологии, только нужно было придумать, как подготовить образцы.
Этим вопросом занялся Жак Дюбоше. Образцы для электронного микроскопа должны находиться в вакууме, но в вакууме вода испаряется, что приводит к разрушению биомолекул. В начале 1980-х Дюбоше решил убрать испарение, просто заморозив воду. Он охлаждал образцы при температуре ниже 200 градусов, так что вода застывала вокруг образца, словно скорлупа. Она переходила из жидкого в стеклоподобное состояние без образования кристаллов льда. Таким образом, молекулы могли сохранять свое естественную форму. Многие исследователи утверждали, что из затеи Дюбоше ничего не получится - нельзя, мол, остекловать каплю воды. Однако в 1982 г. Дюбоше впервые применил свой метод, а в 1984-м опубликовал первые криоэлектронные изображения вирусов.
Однако качество картинки при этом было невысоким. В 1991-м Йоахим Франк создал 3D-изображение рибосом (используя метод стеклования Жака Дюбоше) с разрешением 40 А́нгстремов. Ангстрем - одна десятая нанометра - намного больше размера атома. Несмотря на то что на картинке было видно лишь контуры рибосомы, работа Франка стала серьезным шагом вперед.
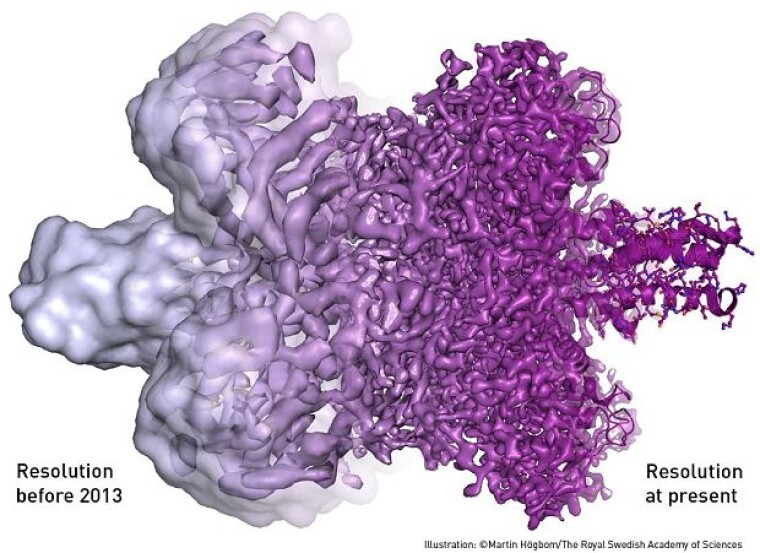
С того времени развитие технологии криоэлектронной микроскопии идет семимильными шагами. Сегодня ученые не просто могут заглянуть внутрь молекулы, но и увидеть ее в 3D-формате, смоделировать ее поведение. Иллюстрацией этого может служить изображение энзима бета-галактозидазы, соединенного с другой молекулой. С левой стороны - снимок, сделанный несколько лет назад, с правой - снимок, сделанный современным микроскопом.
Примечательно, что Нобелевскую премию уже дважды присуждали за исследования, проведенные при помощи криоэлектронной микроскопии. Так, в 2009-м за исследования структуры и функции рибосомы, считывающей информацию с ДНК и синтезирующей белки, премии по химии удостоились Векатраман Рамакришнан из Кембриджа, Томас Стайц из Йельского университета (США) и Ада Йонат из Института Вейцмана (Израиль). А в прошлом году Нобелевскую премию получили Жан-Пьер Соваж, Бернард Феринга и Фрезер Стоддарт "за проектирование и синтез молекулярных машин".
Победить диабет и рак
Главная ценность метода в том, что ученые могут наблюдать за поведением молекул в их естественной среде, а это ключевые процессы как для понимания химии жизни, так и для создания лекарств. Так, в частности, именно благодаря методу, придуманному свежеиспеченными нобелевскими лауреатами, удалось изучить структуру белков, которые вызывают устойчивость к антибиотикам, белковых комплексов, регулирующих биологические часы (за изучение этого феномена в этом году тоже вручили Нобелевскую премию), белкового "датчика давления", который позволяет нам слышать, и даже вируса Зика. Данные наблюдений за миторибосомальными белками уже позволили ученым объяснить побочные действия нескольких классов лекарств. И выяснить, как изменить структуру медпрепаратов, чтобы избежать вредных последствий.
"Понимание нашей иммунной системы - ключевой фактор в борьбе с раком, инфекционными заболеваниями, например малярией, и аутоиммунными заболеваниями, включая диабет и рассеянный склероз. Ключом к пониманию и излечению этих заболеваний является знание того, как протеины и клетки взаимодействуют на молекулярном уровне", - заявил профессор Джеймс Уиссток из университета Монаша (Мельбурн, Австралия) на открытии лаборатории с криоэлектронным микроскопом в своем вузе. Он уверен, что именно такая техника поможет изучить механизмы возникновения рака различных типов, диабета и рассеянного склероза, и на основании полученной информации разработать лекарства от этих болезней.
Нобелевка по химии: история наград
Лишь один ученый дважды получил Нобелевскую премию в отрасли химии: Фредерик Сенгер в 1958 г. был награжден за "исследования структуры белков, особенно инсулина", а в 1980-м получил премию за "вклад в установлении основных последовательностей в нуклеиновых кислотах".
Средний возраст лауреата Нобелевской премии по химии - 58 лет. Самый старший - Джон Фенн, которого в 2002-м наградили за разработку масс-спектрометрического метода исследования биологических макромолекул. Исследования Фенн начал в возрасте 70 лет, премию получил в 85. Самым молодым лауреатом стал Фредерик Жолио, который был награжден в возрасте 35 лет за синтез новых радиоактивных элементов. Премию он получил вместе с женой Ирен Жолио-Кюри, дочерью знаменитой двукратной нобелевской лауреатки (по химии и физике) Марии Склодовской-Кюри.
За все время существования премии лишь четыре женщины получали награды в области химии. Вместе с Ирен Жолио-Кюри следует вспомнить ее мать Марию Склодовскую-Кюри (была награждена в 1911-м "за выдающиеся заслуги в развитии химии, открытие элементов радия и полония, выделения радия и изучения природы и соединений этого элемента"), Дороти Кроуфут Годжкин ( в 1964 г. за определение с помощью рентгеновских лучей структур биологически активных веществ) и Ада Йонат (в 2009-м за исследование структуры и функций рибосомы).
Чаще всего Нобелевская премия по химии присуждается в области биохимии (около 50 наград).