Гальма для раку. За що дали Нобелівку з медицини

У понеділок, 1 жовтня, в Швеції почали оголошувати володарів Нобелівської премії в цьому році. Першими лауреатами - володарями премії в галузі медицини і фізіології стали професор університету Кіото Тасуку Хондзе і професор Техаського університету Джеймс Еллісон. Вчені удостоїлися премії за відкриття терапії раку шляхом активації імунної відповіді. Про те, що рак можна лікувати за рахунок внутрішніх резервів організму, вчені почали говорити ще кілька десятиліть тому. Але підтвердити цей факт і придумати, як примусити організм боротися з шкідливими клітинами, вдалося лише після відкриттів Еллісона та Хондзе, зроблених на різних кінцях землі.
У світі щорічно різними формами раку захворюють близько 10 мільйонів чоловік, більшість з яких помирають. В Україні в 2016-му зареєстрували понад 131 тис. випадків захворювання на рак. І майже 66 тис. випадків смертей від раку.
Свій проти чужих
Історія імунотерапії тісно пов'язана з історією боротьби проти меланоми - однієї з найбільш агресивних злоякісних новоутворень. Саме завдяки вивченню меланоми з'явилися перші імунопрепарати.
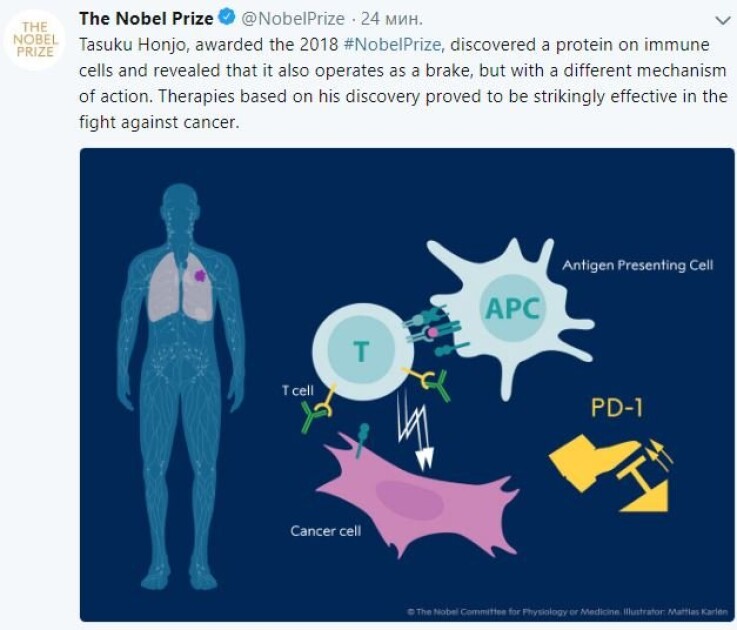
Головна особливість нашої імунної системи - здатність розрізняти "свої" і "чужі" клітини. У разі, якщо в організм потрапляє бактерія або вірус, імунна система маркує їх як чужинців і відправляє на боротьбу з шкідником Т-лімфоцити - різновид білих кров'яних тілець. Серед головних завдань у тому числі руйнування ракових клітин. У лімфоцита є білки-рецептори, які активують клітку або пригнічують її - тобто включають і вимикають. У разі порушення цієї схеми людина починає страждати аутоімунними захворюваннями - його організм бореться сам з собою. Але чи можна включити лімфоцит "вручну"? Саме за відкриття такої кнопки і присудили Нобелівку в цьому році. Змусити клітину вийти на стежку війни можна за допомогою впливу так званих моноклональних антитіл на контрольні точки клітини - рецептори CTLA-4 та PD-1. Контрольні, тому що саме ці білки перевіряють, чи варто запускати імунну відповідь або ніякої небезпеки немає. І хоч обидва білка відносяться до інгібуючим рецепторів, вони діють по-різному.
Рецептори CTLA-4, які знижують активність імунітету, почали вивчати в 90-е і довгий час розглядали виключно в контексті лікування аутоімунних захворювань - щоб змусити тіло припинити боротьбу з самим собою. Однак Джеймсу Еллісону прийшла в голову інша ідея. Він вирішив, що, заблокувавши рецептори лімфоцита, зможе стимулювати імунну систему ефективнішою нападати на ракові клітини. Це припущення підтвердили перші ж досліди, проведені на мишах.
Тасуку Хондзе відкрив білок PD-1. Відмінність в тому, що лімфоцити з такими рецепторами вже знайомі з раковими клітинами. У ракової клітини є рецептор PD-L1, який впливає на лімфоцит і запускає його рецептор PD-1. У підсумку лімфоцит не тільки "не помічає" ракову клітину, він ще й сам стає вразливим для руйнування. Якщо ж білок активувати, то він "гальмує" ракову клітину, не даючи їй розвиватися.
Сьогодні в терапії раку використовують ліки, які запобігають блокування раковою клітиною лімфоцита - для цього антитіла приєднуються до рецепторів PD-1. Таким чином організм може боротися з раком самостійно. Контрольних пунктів, які запускають і гальмують клітку, досить багато. Але поки що вчені змогли навчитися працювати лише з PD-1 і CTLA-4. Причому у випадку з клітиною, яка вже "знайома" з раком, терапія виявляється більш ефективною і супроводжується меншою кількістю ускладнень.
Вперше використовувати кнопку у лимфоците вирішили при терапії меланоми - зареєстрований в 2011-му препарат "Ипилимумаб" діє на рецептори CTLA-4. Правда, допомагає він лише кожного п'ятого пацієнта з меланомою. Між тим з його допомогою вдається досягти тривалої ремісії - до 10 років.
Читайте також: Інструменти світла. За лазери нарешті видали Нобеля
Після "Ипилимумаба" з'явилися препарати, які були направлені на роботу з рецептором PD-1. Вони виявилися більш ефективні - майже половина пацієнтів реагує на лікування. Два препарати - "Ниволумаб" і "Пембролизумаб" - вже зареєстровані для лікування раку легенів. "Ниволумаб" також використовується при лікуванні раку нирки і як частина програми лікування резистентної і рецидивуючої форми класичної лімфоми Ходжкіна. Однак медики зазначають, що найперспективнішим виглядає вплив на обидва рецептора відразу, тому препарати часто призначають в комплексі.
Шлях до нагороди
Джеймс Еллісон народився в 1948-му в Техасі, був молодшим із трьох братів. Коли Джеймсу було 11 років, його мати померла від раку. Батько-отоларинголог зацікавив хлопчика медициною, а шкільний учитель математики - наукою. Під час навчання в ліцеї Еллісон відмовився ходити на лекції по біології, оскільки в програму входило вивчення теорії еволюції ("Біологія без Дарвіна - як фізика без Ньютона", - обурювався майбутній учений). У підсумку Еллісон прослухав курс біології в Університеті Техасу, а потім там же зайнявся мікробіологією, а після імунологією. У 2012-му обійняв посаду професора керівника відділу імунології центру раку М. Д. Андерсона Техаського університету - одного з найкращих онкологічних центрів світу.
Тасуку Хондзе старше свого колеги на шість років. Він народився в Кіото, тут же закінчив університет і захистив докторську з медичної хімії. Після цього деякий час працював в Америці, після цього - в університетах Токіо та Осаки. У 1984-му повернувся в Кіотський університет, де зайняв посаду професора на кафедрі медичної хімії. Останні 13 років Хондзе - професор кафедри імунології та медичної геноміки. Причому Хондзе стверджує, що зайнявся імунологією з чистої цікавості.
Як і Джеймс Еллісон, Хондзе є володарем безлічі нагород, включаючи японський Нобель - премію Кіото. Примітно, що чотири роки тому Хондзе вже отримував нагороду на двох з Еллісоном - премію Тан на Тайвані.
Нобелівську премію - цього року вона складе 9 млн крон ($1,1 млн) - вручать 10 грудня, в день смерті Альфреда Нобеля.